산화 베릴륨
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산화 베릴륨(BeO)은 알칼리 토금속의 산화물 중 유일하게 공유 결합 물질로 간주되며, 베릴륨 원자 크기가 작아 양쪽성 물질이다. 물, 질산에는 녹지 않지만, 진한 황산, 염산, 알칼리 수용액에는 녹는다. 육방정계 섬아연석 구조로 결정화되며, 고온에서는 사방정계 형태로 구조가 변환된다. 산화 베릴륨은 탄산 베릴륨의 소성, 수산화 베릴륨의 탈수, 금속 베릴륨의 점화 등을 통해 제조할 수 있다. 원자로의 감속제, 특수 유리, 세라믹 등에 사용되며, 우수한 열전도체이자 전기 절연체 특성을 활용하여 반도체 부품, 히트싱크, 로켓 엔진 재료 등으로 사용된다. 분말 형태의 산화 베릴륨은 발암 물질이며 베릴륨증을 유발할 수 있어 취급에 주의가 필요하다.
더 읽어볼만한 페이지
- 베릴륨 화합물 - 녹주석
녹주석은 육방정계에 속하는 규산염 광물로, 다양한 색상을 띠며 베릴륨 화합물로 알려져 채굴, 취급, 정제 시 폐렴을 유발할 수 있다. - 베릴륨 화합물 - 베릴륨화 리튬
베릴륨화 리튬은 제대로 연구되거나 관찰되지 않은 화합물이며, 현재까지 정보가 제한적이고 추가적인 연구가 필요하다. - II-VI 반도체 - 황화 카드뮴
황화 카드뮴은 카드뮴 염을 황 이온으로 침전시켜 제조하며, 반도체, 안료 등으로 사용되지만 독성이 있어 흡입 시 위험하고 발암 물질로 분류된다. - II-VI 반도체 - 산화 아연
산화 아연(ZnO)은 흰색 분말 형태의 양쪽성 산화물로, 고무, 안료, 의약품, 세라믹, 전자 장치 등 다양한 산업 분야에 사용되며 높은 굴절률, 열전도율, 항균성 및 자외선 차단 능력을 지닌 물질이다. - 핵기술 - 원자로
원자로는 제어된 핵분열을 통해 열에너지를 생산하여 전기 생산, 추진 동력원, 연구 등에 활용되며, 핵분열 연쇄 반응을 제어봉과 감속재로 조절하고, 원자력 안전과 미래 기술 개발이 중요한 과제이다. - 핵기술 - 핵무기 설계
핵무기 설계는 핵분열 및 핵융합 반응을 이용하여 막대한 에너지를 방출하는 핵무기를 설계하는 복잡한 과정으로, 핵분열성 물질의 임계 질량을 초임계 질량으로 신속하게 조립하는 다양한 방식과 고급 기술이 적용되며, 효율성 증대 및 안전성 확보, 방사능 낙진 최소화 등의 기술적·공학적 도전 과제들이 존재한다.
2. 특성
산화 베릴륨은 물이나 질산에는 녹지 않지만, 진한 황산이나 염산, 알칼리 수용액에는 녹는다. 알칼리 수용액에서 용해되는 반응식은 다음과 같다.
:BeO + 2OH- + H2O → Be(OH)42-
베릴륨을 공기 중에서 점화하면 BeO와 Be3N2의 혼합물이 생성된다.[1] 다른 2족 원소(알칼리 토금속)가 형성하는 산화물과 달리, 산화 베릴륨은 염기성이 아니라 양쪽성을 띤다.
고온(800 °C 이상)에서 생성된 산화 베릴륨은 불활성이지만, 뜨거운 수용액의 플루오르화수소산암모늄(NH4HF2) 또는 뜨거운 진한 황산(H2SO4)과 황산 암모늄((NH4)2SO4) 용액에 쉽게 용해된다.
산화 알루미늄과도 유사하며, 강렬한 결정질의 것은 물, 산 및 알칼리에 불용성이지만, 진한 황산 및 진한 염산과 가열하면 황산 베릴륨 및 염화 베릴륨을 각각 생성하여 용해된다. 또한 모스 경도도 9도로 코런덤에 필적한다. 플루오르화 수소산에는 플루오로착물을 생성하여 용해된다.
:
:
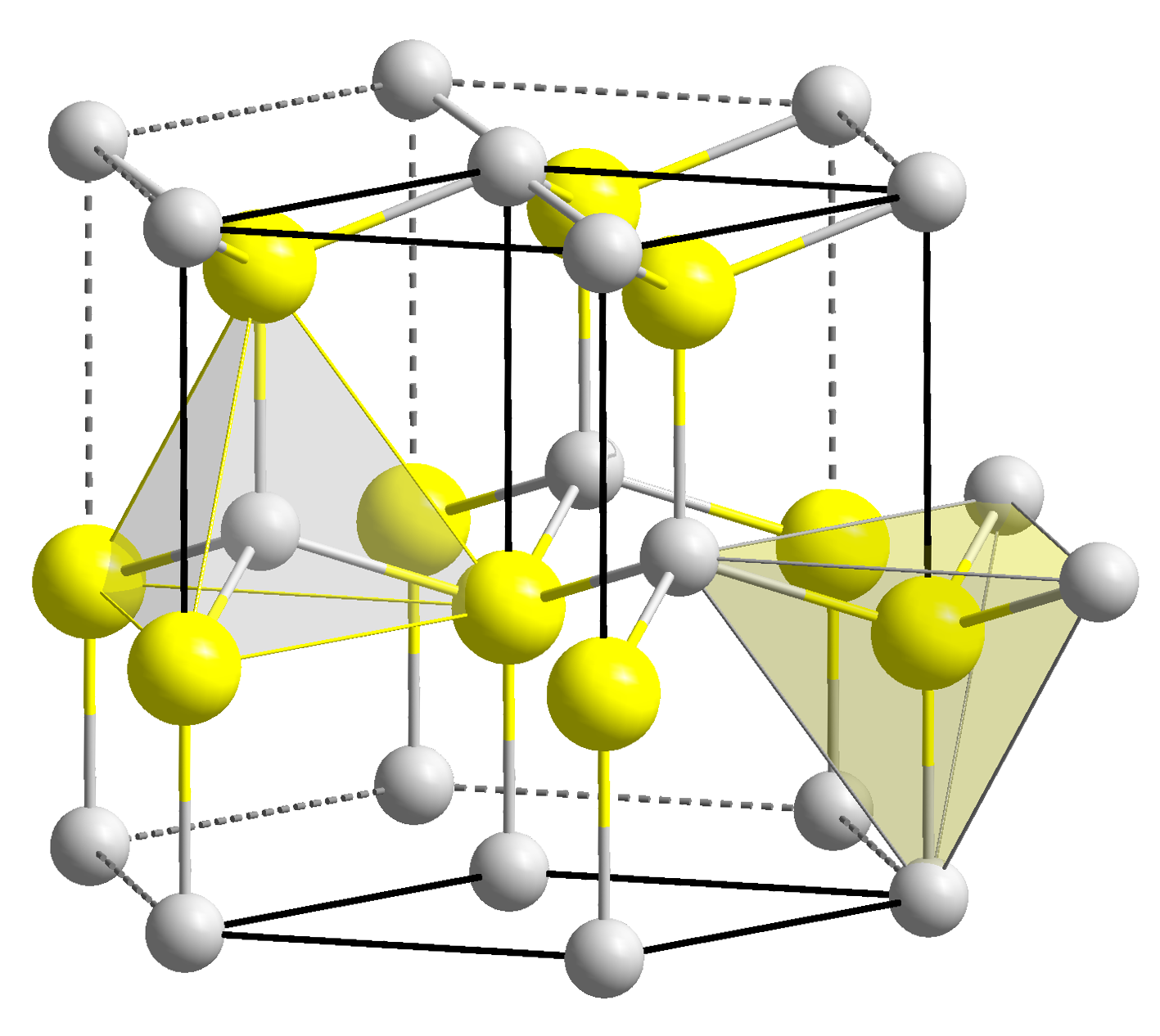
2. 1. 구조
산화 베릴륨은 알칼리 토금속의 산화물 중에서는 유일하게 공유 결합 물질로 간주된다. 이는 베릴륨의 원자 크기가 다른 2족 원소에 비해 상대적으로 작기 때문이다. 같은 이유로 산화 베릴륨은 양쪽성 물질이다.[1]BeO는 육방정계 섬아연석 구조로 결정화되며, 론스데일석 및 w-BN(이들 모두와 등전자성이다)과 마찬가지로 사면체 Be2+ 및 O2− 중심을 특징으로 한다. 반대로, 더 큰 2족 금속의 산화물, 즉 MgO, CaO, SrO, BaO는 이온들 주위에 팔면체 기하학을 가진 입방 염화나트륨 모티프로 결정화된다.[1] 고온에서는 사방정계 형태로 구조가 변환된다.[14]
기체 상태에서 산화베릴륨은 별개의 이원자 분자로 존재한다. 원자가 결합 이론의 언어로는, 이 분자들이 두 원자 모두에서 ''sp'' 오비탈 혼성화를 채택하고, 하나의 시그마 결합(각 원자의 하나의 ''sp'' 오비탈 사이)과 하나의 파이 결합(분자 축에 수직으로 배향된 각 원자의 정렬된 ''p'' 오비탈 사이)을 특징으로 한다고 설명할 수 있다. 분자 궤도 함수 이론은 두 원자의 2''s'' 오비탈이 채워진 시그마 결합 궤도 함수와 채워진 시그마* 반결합 궤도 함수를 형성하기 때문에 ''순수한'' 시그마 결합이 없고, 분자 축에 수직으로 배향된 ''p'' 오비탈 쌍 모두 사이에 형성된 두 개의 파이 결합이 있는 약간 다른 그림을 제공한다. 분자 축을 따라 정렬된 ''p'' 오비탈에 의해 형성된 시그마 궤도 함수는 채워지지 않는다. 해당 기저 상태는 ...(2sσ)2(2sσ*)2(2pπ)4(등전자성 C2 분자와 같음)이며, 여기서 두 결합 모두 산소에서 베릴륨으로의 배위 결합으로 간주될 수 있다.[15]
염화나트륨형 구조와 다른 알칼리토금속 산화물과 달리, 산화베릴륨(BeO)의 결정은 육방정계의 융석형 구조이며, 베릴륨 및 산소 원자는 4배위이다.[24][27] 그 격자상수는 a = 2.66Å, c = 4.37Å이다.[24] 복굴절을 나타내며, 굴절률은 보통 광선에 대해 1.719, 이상 광선에 대해 1.733이다.
3. 제조법
산화 베릴륨은 탄산 베릴륨을 소성(가열)하거나, 수산화 베릴륨을 탈수시키거나, 금속 베릴륨을 점화시켜 제조할 수 있다.[1]
:BeCO3 → BeO + CO2
:Be(OH)2 → BeO + H2O
:2 Be + O2 → 2 BeO
베릴륨을 공기 중에서 점화하면 BeO와 Be3N2의 혼합물이 생성된다.[1]
800 °C 이상의 고온에서 생성된 산화베릴륨은 불활성이지만, 뜨거운 플루오르화수소산암모늄(NH4HF2) 수용액이나 뜨거운 진한 황산(H2SO4)과 황산암모늄((NH4)2SO4) 용액에는 쉽게 용해된다.[24][25]
수산화베릴륨(Be(OH)₂) 또는 탄산베릴륨(BeCO₃)을 열분해하여 생성할 수도 있다.[24][25]
:
:
질산베릴륨(Be(NO₃)₂)을 열분해하여 생성하는 방법도 있다.[26]
:
4. 응용 분야
산화 베릴륨은 원자로의 감속제나 특수 유리, 세라믹 등에 사용된다. 고품질 결정은 수열 합성법 또는 베르누이법으로 성장시킬 수 있다. 대부분 산화베릴륨은 흰색 비정질 분말로 생산되어 더 큰 형태로 소결된다. 탄소와 같은 불순물은 무색의 모체 결정에 다양한 색을 낼 수 있다.
소결된 산화베릴륨은 매우 안정적인 세라믹이다.[16] 산화베릴륨은 로켓 엔진과 알루미늄으로 도금된 망원경 거울의 투명한 보호 코팅으로 사용된다. 금속 코팅 산화베릴륨(BeO) 플레이트는 항공기 구동 장치의 제어 시스템에 사용된다.[17]
산화베릴륨은 우수한 열전도성과 더불어 우수한 전기 절연체이기 때문에 무선 장비와 같은 응용 분야의 많은 고성능 반도체 부품에 사용된다. 써멀 그리스와 같은 일부 열 인터페이스 재료의 충전제로 사용된다.[18] 또한 CPU, 레이저 및 전력 증폭기와 같은 전자 장치를 냉각하는 히트싱크 및 스프레더에도 사용된다.[19] 일부 전력 반도체 소자는 실리콘 칩과 패키지의 금속 장착 베이스 사이에 산화베릴륨 세라믹을 사용하여 알루미늄 산화물과 유사한 구조보다 더 낮은 열 저항 값을 달성했다. 또한 고성능 마이크로웨이브 장치, 진공관, 마그네트론 및 기체 레이저의 구조용 세라믹으로도 사용된다. BeO는 해군 해양 고온 가스 냉각 원자로(MGCR) 및 우주 응용 분야를 위한 NASA의 킬로파워 원자로의 중성자 감속재로 제안되었다.[20]
산화베릴륨은 로켓 엔진의 재료, 촉매, 원자로의 제어재 및 중성자 반사재로 사용된다. 또한 산화베릴륨은 우수한 전기 절연체이면서 열의 열전도체이기 때문에 반도체 부품의 재료로 사용된다.
5. 안전성
다른 모든 베릴륨 화합물과 같이 산화 베릴륨은 만성적인 베릴륨증을 유발할 수 있다. 산화베릴륨(BeO)은 분말 형태일 경우 발암물질이며[21], 만성 알레르기성 폐 질환인 베릴륨증을 유발할 수 있다. 고체 형태로 소결된 경우에는 분진을 발생시키는 가공을 하지 않는 한 취급해도 안전하다. 깨끗하게 파손된 경우에는 분진이 거의 발생하지 않지만, 분쇄하거나 연마하는 작업은 위험을 초래할 수 있다.[22]
참조
[1]
웹사이트
beryllium oxide – Compound Summary
https://pubchem.ncbi[...]
National Center for Biotechnology Information
2005-03-27
[2]
문서
Haynes
[3]
문서
Haynes
[4]
논문
Wide-band gap oxide alloy: BeZnO
2006
[5]
문서
Haynes
[6]
웹사이트
Bromellite Mineral Data
http://www.webminera[...]
[7]
문서
Haynes
[8]
문서
Haynes
[9]
문서
Haynes
[10]
문서
Beryllium oxide toxicity
[11]
문서
PGCH
[12]
문서
REDIRECT
[13]
서적
Materials for Engineers and Technicians
https://archive.org/[...]
Newnes
[14]
서적
Structural Inorganic Chemistry
Oxford Science Publications
[15]
서적
Fundamentals of Spectroscopy
https://books.google[...]
Allied Publishers
[16]
논문
Beryllium and Beryllium Compounds
Wiley-VCH, Weinheim
[17]
웹사이트
What Are the Ceramic Materials With High Thermal Conductivity?
https://www.samateri[...]
2023-12-27
[18]
웹사이트
Thermal conductivity in advanced chips — Emerging generation of thermal greases offers advantages
http://www.apmag.com[...]
[19]
웹사이트
Beryllia (BeO)
https://www.precisec[...]
[20]
웹사이트
KiloPower Space Reactor Concept – Reactor Materials Study
http://permalink.lan[...]
2014-05-14
[21]
웹사이트
Hazardous Substance Fact Sheet
https://nj.gov/healt[...]
New Jersey Department of Health and Senior Services
[22]
웹사이트
Beryllium Oxide Safety
https://www.american[...]
[23]
논문
The NBS tables of chemical thermodynamics properties
[24]
서적
化学大辞典
共立出版
[25]
서적
Inorganic Chemistry
Elsevier
[26]
서적
新実験化学講座 無機化合物の合成I
丸善
[27]
서적
コットン・ウィルキンソン無機化学
培風館
[28]
웹인용
beryllium oxide – Compound Summary
https://pubchem.ncbi[...]
National Center for Biotechnology Information
2005-03-27
[29]
서적
Chemical Principles 6th Ed.
https://archive.org/[...]
Houghton Mifflin Company
[30]
문서
PGCH
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com